L’échelle locale
L’échelle « grande distance »
Les solides cristallins
Les solides non cristallins ou amorphes
Les matières « hors catégories »
Les atomes de la matière se positionnent les uns par rapport aux autres dans l’espace, d’une manière déterminée par la température et la pression, et par la nature des interactions entre eux. La structure atomique qui en résulte est décrite à deux échelles :
– L’échelle locale, celle de la molécule ou des atomes premiers voisins (1 Å à 1 nm)
– L’échelle « grande distance » : le nm à la centaine de nm. C’est à cette échelle qu’on distingue les états gazeux, liquides, solides et intermédiaires (gels…), ainsi que les solides cristallins par opposition aux solides désordonnés ou amorphes.
L’échelle locale
Les interactions entre atomes se modélisent par une énergie potentielle et des « positions d’équilibre » qui correspondent au minimum d’énergie potentielle. La figure ci-dessous représente l’énergie potentielle entre 2 atomes et leur position d’équilibre. Pour une assemblée d’atomes, on peut de même représenter la surface d’énergie potentielle dans l’espace des configurations atomiques : cette surface attribue une valeur d’énergie potentielle pour chaque configuration de l’assemblée. Les minima de cette surface sont les configurations atomiques énergétiquement favorables.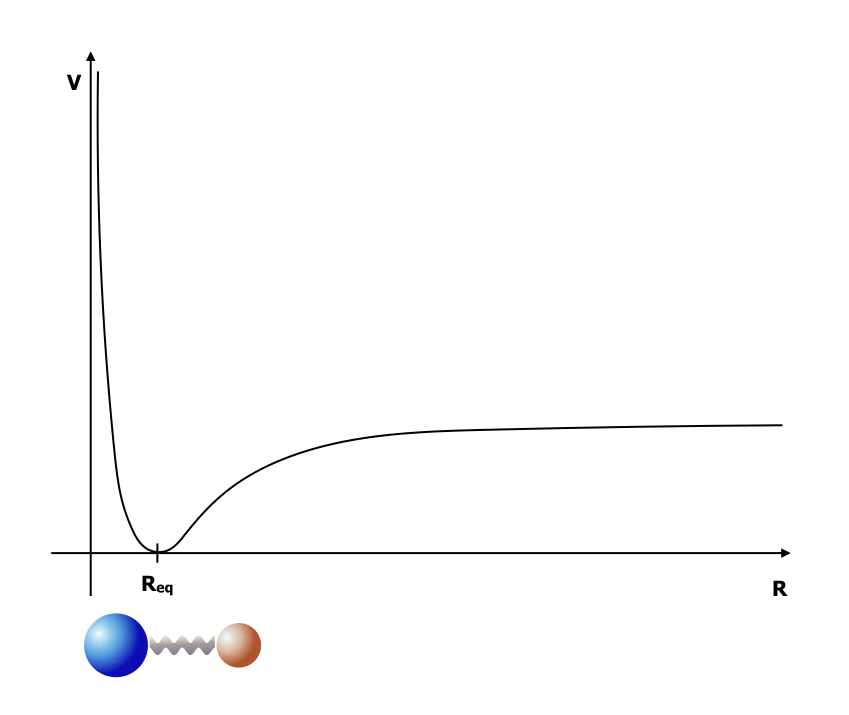
Potentiel interatomique entre un atome A (sphère bleue) et un atome B (sphère orange). La distance d’équilibre Req correspond au minimum de potentiel. En lui-même, le potentiel représente la force de rappel exercée sur les atomes par les électrons de la liaison chimique. Cette force de rappel est modélisée par le petit ressort entre les atomes A et B.
Dans une molécule ou un composé, on trouve souvent plusieurs fois les mêmes atomes et liaisons. Par exemple la molécule d’eau contient deux liaisons « O-H » identiques. Cela génère des éléments de symétrie : la molécule d’eau a un axe binaire et un miroir contenant cet axe. On utilise ces éléments de symétrie pour décrire la structure de la molécule, la forme de ses orbitales moléculaires et de ses modes de vibration.
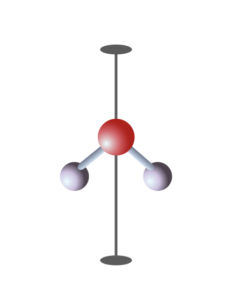 Molécule d’eau : atome d’oxygène en rouge et atomes d’hydrogène en blanc. L’axe vertical est l’axe de symétrie binaire qui caractérise la structure de cette molécule. La structure comprend aussi un miroir dans le plan de la molécule et un miroir perpendiculaire au plan. L’axe binaire est à l’intersection des deux miroirs. Ce groupe de symétrie est appelé « C2v » ou « 2mm » selon les deux notations utilisées en spectroscopie ou en cristallographie.
Molécule d’eau : atome d’oxygène en rouge et atomes d’hydrogène en blanc. L’axe vertical est l’axe de symétrie binaire qui caractérise la structure de cette molécule. La structure comprend aussi un miroir dans le plan de la molécule et un miroir perpendiculaire au plan. L’axe binaire est à l’intersection des deux miroirs. Ce groupe de symétrie est appelé « C2v » ou « 2mm » selon les deux notations utilisées en spectroscopie ou en cristallographie.
L’échelle « grande distance »
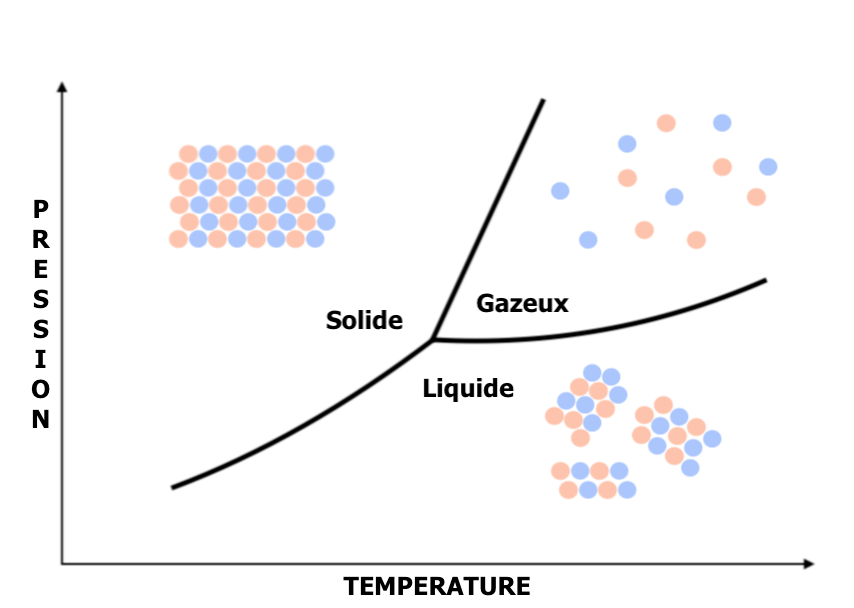
La température et la pression déterminent trois situations bien différentes à grande distance :
L’état gazeux : les atomes ou molécules, éloignés les uns des autres, n’ont pas d’interaction entre eux et se répartissent de façon totalement aléatoire dans le volume. Leur vitesse est distribuée de façon aléatoire.
L’état liquide : Les atomes ou molécules sont beaucoup plus proches les uns des autres et commencent à interagir. Une structure apparaît à courte distance, là où les interactions sont les plus fortes. Mais comme les atomes (ou molécules) se déplacent en permanence les uns par rapport aux autres, l’ordre ne peut pas s’établir à longue distance. Il y a du désordre au niveau des angles, des orientations entre espèces, créant un certain volume libre. Au-delà des entités locales de base (atome, molécule, complexe…), la structure d’un liquide se caractérise par des distributions statistiques autour de grandeurs moyennes (distances interatomiques ou intermoléculaires, orientations relatives…). A cause du désordre d’orientation, la structure d’un liquide est isotrope : elle est statistiquement la même dans toutes les directions.
L’état solide : Cette fois l’ensemble des atomes est rapproché et le volume libre est très limité. Les atomes ou molécules interagissent avec leurs voisins directs mais aussi avec leurs voisins plus éloignés selon la portée des interactions. Les atomes ne se déplacent plus les uns par rapport aux autres, leurs mouvements se réduisent à des vibrations autour des positions d’équilibre fixes (c’est précisément ce qui différencie un solide d’un liquide). Ces positions d’équilibre correspondent aux minimas de la surface d’énergie potentielle.
La structure atomique à l’état solide est ce qui nous intéresse le plus ici. Au niveau des solides, une distinction importante est faite entre solides cristallins et solides non cristallins ou amorphes. Certaines matières se rangent entre ces catégories : ni complètement solides, ni complètement liquides, ni complètement cristallines, ni complètement amorphes.
Les solides cristallins
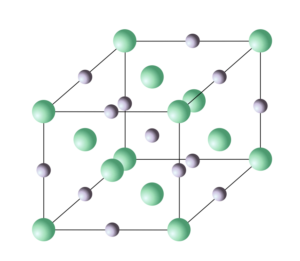
Dans le solide NaCl, tous les Na sont équivalents entre eux (idem pour les Cl). Cela signifie qu’on passe d’un atome de Na particulier à un autre atome de Na par des opérations de symétrie. Ces opérations sont de deux natures :
Les opérations de symétrie ponctuelles : centre d’inversion, axes de rotation et miroirs,
Les opérations de symétrie translatoire : l’atome est translaté à une certaine distance dans une certaine direction.
Ces opérations se combinent de la façon suivante :
Une maille élémentaire, qui contient un petit nombre d’atomes Na et Cl reliés par des opérations de symétrie et qui possède elle-même une certaine symétrie. La maille de NaCl contient 4 atomes de Na et 4 atomes de Cl et a la forme d’un cube,
La répétition de la maille élémentaire dans les trois directions de l’espace, qui forme le réseau périodique ou réseau cristallin. On passe d’une maille à une autre par une translation « de réseau ».

[Mettre avec une photo d’une trame textile avec son maillage]
Un solide formé de la répétition périodique d’une maille est un solide cristallin ou « cristal ». L’ordre cristallin est omniprésent dans la matière : c’est lui qui permet d’atteindre le minimum d’énergie potentielle de l’assemblée d’atomes qui constituent tout solide. En effet la configuration atomique locale la plus optimale du point de vue des interactions se trouve répétée dans l’espace. Pour cette raison, l’état thermodynamique le plus stable de toute matière solide est toujours une phase cristalline ou une assemblée de phases cristallines. Toutefois, selon les conditions d’élaboration, on peut obtenir des solides dont la structure s’éloigne de l’ordre cristallin. Leur énergie interne est donc supérieure à l’énergie interne du même composé à l’état cristallin. Thermodynamiquement ces solides sont dans des états d’équilibre métastables, ou bien ils sont « hors d’équilibre ».
Les solides non cristallins ou amorphes
Ce sont les solides qui ne présentent pas de périodicité structurale : on n’y trouve pas de maille qui se répète périodiquement dans l’espace. Il n’y a pas d’opération de symétrie qui permette de passer de l’atome central à un atome très éloigné : il n’y a donc pas d’ordre à grande distance.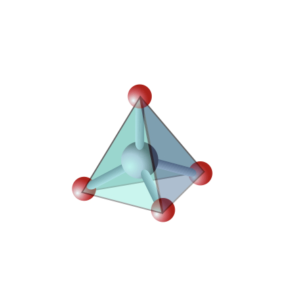 Ces structures non cristallines ou amorphes apparaissent lorsque l’ordre local possède un ou des degrés de liberté. Un exemple bien connu est celui du verre de silice, SiO2. Le silicium a une valence de 4, l’oxygène une valence de 2. La stœchiométrie est donc de 2 oxygènes pour un silicium. Localement, le silicium établit 4 liaisons iono-covalentes avec 4 oxygènes, qui eux-mêmes se lient à 2 siliciums. L’ordre local autour du Si est très bien défini, c’est un tétraèdre parfait. En revanche, il existe un certain désordre autour de l’oxygène : l’angle Si-O-Si est flexible, il peut prendre toute une distribution de valeurs sans que cela ne coûte en énergie interne. C’est un degré de liberté structural. D’un tétraèdre SiO4 à son voisin, l’angle n’est pas le même, et de proche en proche l’ordre à longue distance est perdu.
Ces structures non cristallines ou amorphes apparaissent lorsque l’ordre local possède un ou des degrés de liberté. Un exemple bien connu est celui du verre de silice, SiO2. Le silicium a une valence de 4, l’oxygène une valence de 2. La stœchiométrie est donc de 2 oxygènes pour un silicium. Localement, le silicium établit 4 liaisons iono-covalentes avec 4 oxygènes, qui eux-mêmes se lient à 2 siliciums. L’ordre local autour du Si est très bien défini, c’est un tétraèdre parfait. En revanche, il existe un certain désordre autour de l’oxygène : l’angle Si-O-Si est flexible, il peut prendre toute une distribution de valeurs sans que cela ne coûte en énergie interne. C’est un degré de liberté structural. D’un tétraèdre SiO4 à son voisin, l’angle n’est pas le même, et de proche en proche l’ordre à longue distance est perdu.
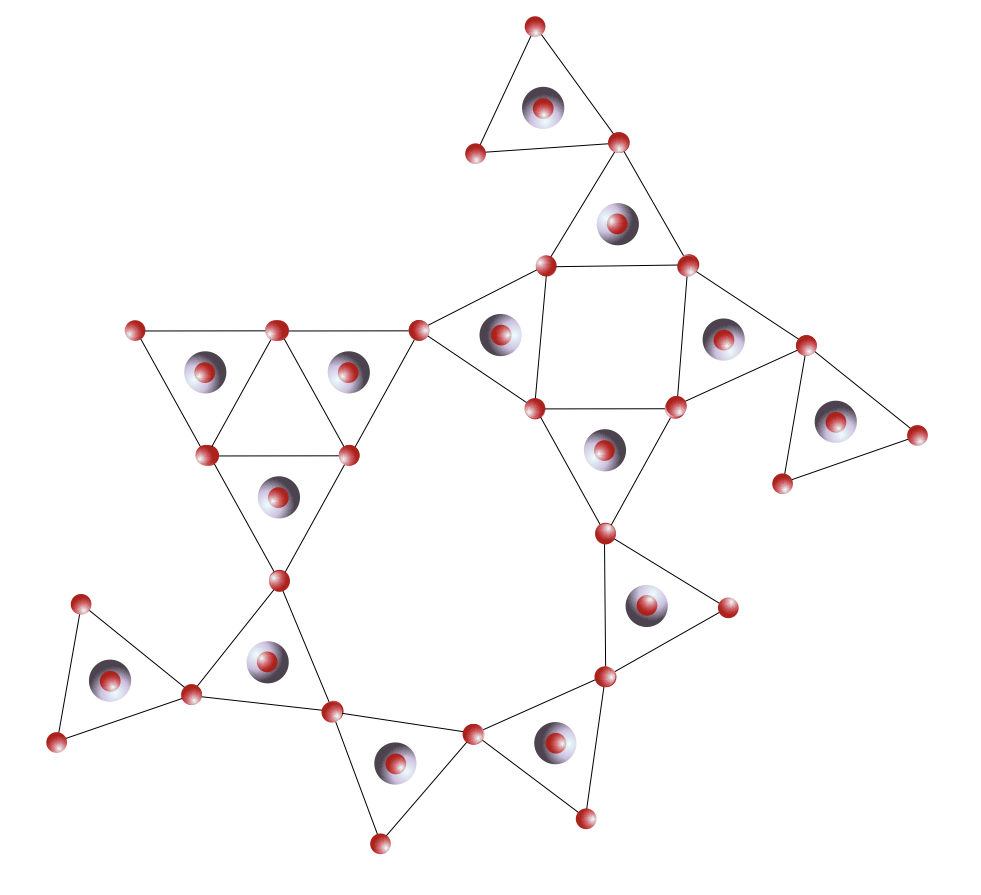
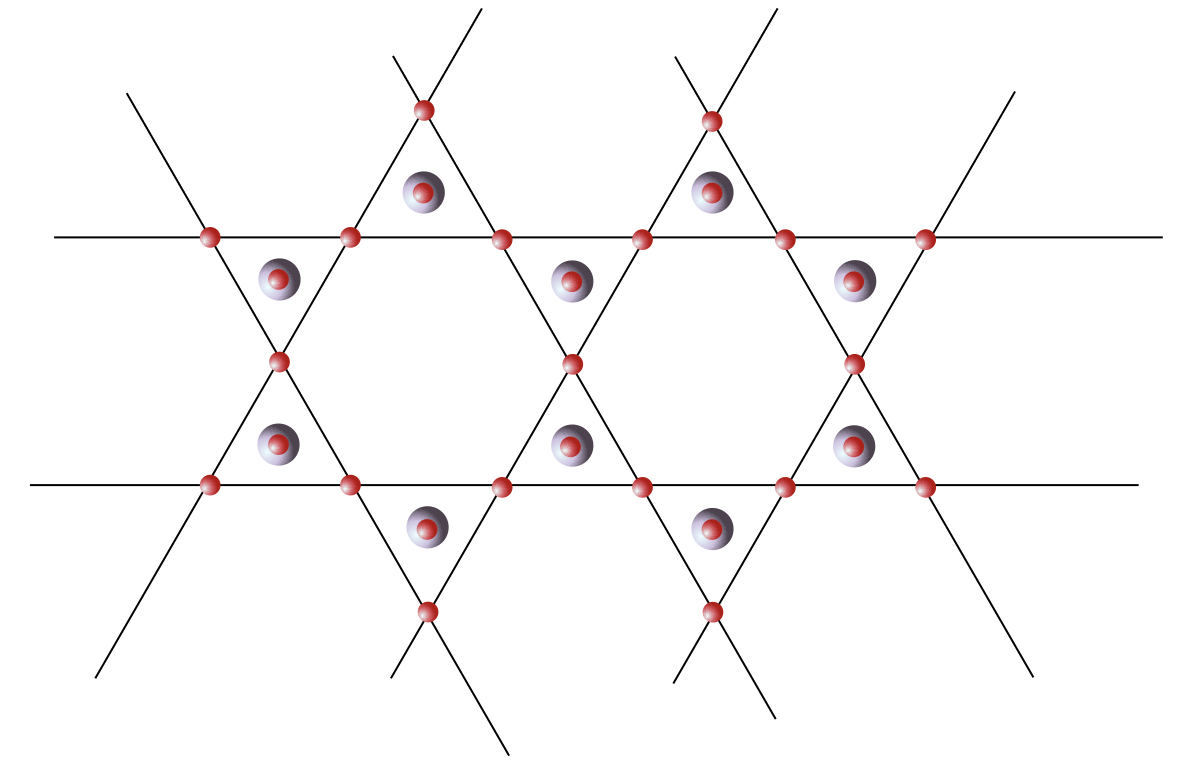
Mettre en parallèle des trames périodiques et désordonnées si il y en a.
Les solides non cristallins qui présentent le phénomène de transition vitreuse sont appelés des verres. Ils sont obtenus par refroidissement rapide d’un liquide de façon à éviter le phénomène de cristallisation. Il existe des solides amorphes qui ne sont pas des verres : c’est par exemple le cas des gels qui sont obtenus par condensation dans un solvant puis évaporation ou sublimation du solvant. Dans ces conditions de basse température, l’ordre cristallin n’a pas pu s’établir et le gel est soit mal cristallisé, soit tout à fait amorphe.
Les matières « hors catégories »
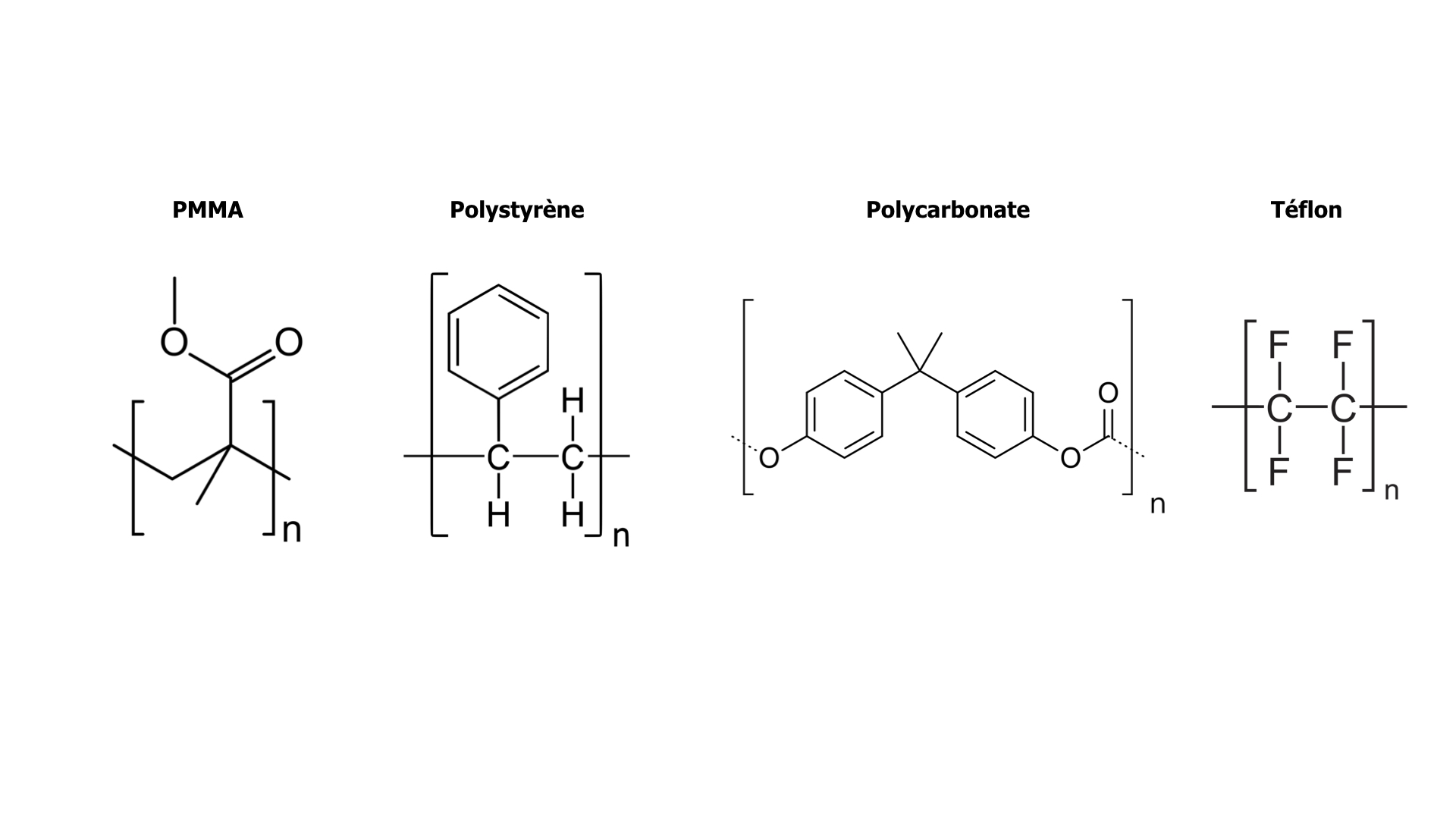
Les polymères sont typiquement des matières qui ne se rangent pas simplement dans les catégories liquide/solide ou cristallin/non cristallin. Ils sont formés de l’enchaînement de monomères en très, très grandes molécules, les « macromolécules ». La structure interne de ces macromolécules présente des degrés de liberté au niveau des angles entre les maillons. De plus, les interactions entre ces macromolécules sont plutôt faibles : elles n’imposent pas un ordre précis dans l’arrangement intermoléculaire. Résultat : soit le polymère est totalement amorphe, soit des domaines cristallins coexistent avec des domaines non cristallins. On dit alors que le polymère est semi-cristallin. Par exemple :
Le polystyrène (PS), le polyméthacrylate de méthyle (PMMA), le polycarbonate (PC) sont des polymères amorphes présentant une transition vitreuse,
A l’opposé le téflon, avec ses fortes interactions intermoléculaires, est un polymère semi-cristallin fortement cristallisé.
Les polymères semi-cristallins peuvent aussi avoir un caractère solide mal défini. Les parties cristallines, solides, coexistent avec des parties amorphes au-dessus de leur température de transition vitreuse. Ces parties amorphes ont alors un comportement caoutchouteux, elles peuvent être étirées ou déformées.
