Un préalable essentiel : la conductivité électronique
Les autres propriétés électriques
Les propriétés optiques
Un préalable essentiel : la conductivité électronique
La conductivité électronique est la capacité du matériau à faire circuler un courant d’électrons entre le pôle négatif (source d’électrons) et le pôle positif (puits d’électrons).
Cette propriété est liée à la quantité d’électrons libres de circuler dans le matériau. Ces électrons sont nécessairement dans des orbitales délocalisées sur l’ensemble du solide, et partiellement occupées, c’est-à-dire occupées par un seul électron.
Nous avons vu dans l’article sur les électrons, objets quantiques, que dans les solides, les orbitales de valence qui se recouvrent forment des orbitales de type moléculaire où l’électron est délocalisé sur tout le solide, et dont les énergies forment des bandes continues. Ce sont l’étendue, les positions relatives et le remplissage de ces bandes qui vont déterminer si un matériau est conducteur électronique, semi-conducteur ou isolant.
Prenons l’exemple du sodium, Na, qui possède un électron de valence dans une orbitale 3s (sa configuration électronique de valence est donc 3s1). Dans le solide Na pur, les orbitales 3s se recouvrent et forment une bande 3s à moitié remplie. Les orbitales 3p, vides, se recouvrent aussi et forment une bande vide située au-dessus de la bande 3s mais en recouvrement partiel avec elle. A la température de 0 K (zéro absolu), les électrons occupent exactement la moitié de la bande, à raison de 2 électrons par orbitale. La conductivité est alors nulle puisque ces électrons appariés ne sont pas mobiles (quand l’un va dans un sens, l’autre va dans l’autre sens). C’est en élevant la température que les électrons situés près du niveau de Fermi, le plus haut niveau occupé, peuvent passer dans des orbitales supérieures. Les orbitales autour du niveau de Fermi deviennent partiellement occupées et une certaine quantité d’électrons « libres » apparaît. Le sodium est donc conducteur électronique.
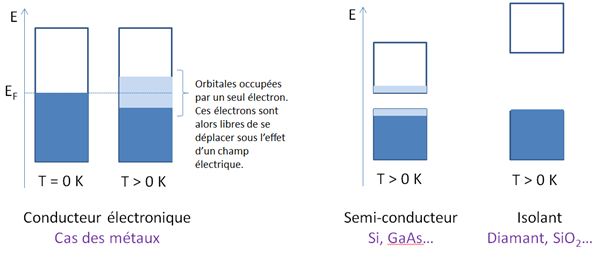
Structure de bandes d’un matériau conducteur électronique, semi-conducteur ou isolant. T est la température, EF est l’énergie de Fermi. La bande est représentée par un rectangle sur l’axe des énergies avec en bleu foncé les niveaux occupés par 2 électrons, en bleu clair ceux occupés par un électron et responsables de la conductivité électronique.
Dans le cas du magnésium (Mg, configuration 3s2) situé à droite du sodium dans le tableau périodique, c’est le recouvrement de la bande 3s avec la bande 3p qui explique la conductivité, puisque cela forme une grande bande partiellement vide. L’aluminium (Al, configuration 3s2, 3p1) est aussi conducteur. De façon générale, tous les métaux dans le sens de la chimie, et leurs alliages sont des conducteurs électroniques, cette propriété fait partie du « caractère métallique » d’une matière. Elle s’associe à des propriétés optiques particulières vues un peu plus loin. Mais la conductivité électronique n’est pas l’apanage des métaux et alliages et même parmi eux on trouve de plus ou moins bons conducteurs, car leurs électrons libres sont en fait plus ou moins « libres » selon l’attraction qu’exercent sur eux les atomes.
Si on va un peu plus à droite dans le tableau, on trouve le silicium, Si, de configuration 3s2, 3p2. Son niveau 3p est donc partiellement rempli (il peut contenir jusqu’à 6 électrons) et pourtant, le solide silicium n’est pas conducteur électronique comme un métal, c’est un semi-conducteur. Pourquoi ?
Dans Si, qui possède 3 protons de plus que Na dans son noyau (Z(Si) = 14 et Z(Na) = 11), les électrons de valence 3s et 3p sont fortement attirés par le noyau. En conséquence, dans le solide Si, la liaison chimique a un caractère covalent et non métallique : les électrons de valence sont partagés entre les atomes Si voisins et sont peu délocalisés. Le recouvrement des orbitales liantes, portant chacune 2 électrons, forme une bande pleine, tandis que le recouvrement des orbitales antiliantes forme une bande vide située au-dessus de la bande pleine. C’est la situation typique du semi-conducteur : il faut chauffer pour promouvoir des électrons dans la bande vide et obtenir de la conductivité.
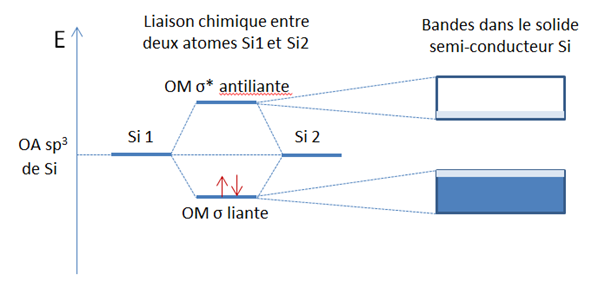
Formation de la liaison chimique entre deux atomes Si et structure de bande associée dans le solide Si. Pour chaque atome Si, l’orbitale atomique 3s et les 3 orbitales atomiques 3p s’hybrident pour former 4 orbitales atomiques de type sp3 (symétrie tétraédrique), chacune portant un électron. C’est le couplage de ces OA puis leur recouvrement dans le solide qui forme deux bandes assez proches en énergie, typiques d’un semi-conducteur. La température ambiante est suffisante pour promouvoir quelques électrons dans la bande vide, appelée « bande de conduction ».
Pour P, S et Cl, les 3 éléments les plus à droite de la 3ème période (excepté l’inerte argon), les électrons de valence sont si attachés aux noyaux qu’ils ne sont pas du tout délocalisés, autrement dit, leurs orbitales moléculaires, aussi bien liantes qu’antiliantes, ne se recouvrent pratiquement pas. Dans les conditions ambiantes, P et S sont des solides moléculaires, formés de molécules en interaction faible entre elles. Cl forme le gaz Cl2, les atomes de chlore partageant chacun un électron dans la molécule Cl2. Pour ces trois substances, évidemment, il n’y a aucune conductivité électronique.
Dans les composés iono-covalents, la conductivité électronique peut être très variable selon la composition chimique et la structure. La silice SiO2, qu’elle soit cristalline (quartz, cristobalite…) ou amorphe (verre), est toujours isolante, car la liaison Si-O est fortement ionique. Il y a donc une trop grande différence d’énergie entre la bande pleine et la bande vide. De la même façon, tous les sels sont isolants. A l’opposé, une certaine conductivité électronique de type métallique existe dans des composés comme TiO, VO (où les orbitales d partiellement vides forment une bande) ou dans des composés à valence mixte comme la magnétite Fe3O4. Ce composé contient les deux valences Fe2+ et Fe3+ et les électrons peuvent « sauter » des ions Fe2+ vers les voisins Fe3+ pour conduire un courant.
Les autres propriétés électriques
Maintenant que nous avons bien établi la distinction entre conducteurs électroniques et isolants, nous allons poursuivre, de façon plus concise, notre exploration des propriétés électriques avec deux observations :
- Une matière peut conduire le courant sans pour autant conduire des électrons. Heureusement ! C’est ce qui permet la réalisation de piles et batteries. En effet les électrons ne sont pas les seuls porteurs de charge électrique : les ions sont aussi porteurs de charge et peuvent dans certains cas être mobiles. On parle de conductivité ionique. Un conducteur ionique sépare la cathode et l’anode dans une pile de façon à boucler le circuit électrique, sans court-circuiter la pile.
- Les matières isolantes ne sont pas dépourvues de réponse lorsqu’elles sont soumises à un champ électrique ! Elles se polarisent sous l’effet du champ. Ce sont donc des diélectriques avec des comportements variés à l’origine de nombreuses fonctionnalités.
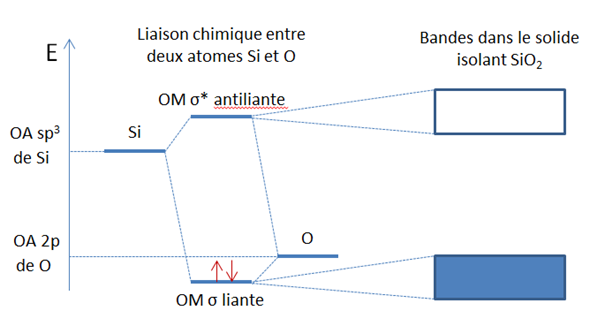
Formation de la liaison chimique iono-covalente entre Si et O et structure de bande associée dans le solide SiO2. La forte ionicité de la liaison entraîne le caractère isolant électronique du composé.
Les conducteurs ioniques
L’archétype du conducteur ionique est la solution saline (des ions dispersés dans un solvant, par exemple de l’eau). Mais comme nous nous intéressons d’abord aux matériaux, nous allons parler des solides !
Pour obtenir un solide conducteur ionique, il faut d’abord prendre un composé ionique, comme un sel ou un oxyde, et faire en sorte que certains de ses ions puissent se déplacer sous l’effet du champ. Pour se déplacer, il faut que l’ion ait autour de lui des « places vides », c’est-à-dire des sites lacunaires, dans lesquels il va pouvoir « sauter ». Certaines structures sont naturellement riches en sites vacants, telles que l’alumine-beta ou le « NASICON ». Dans des structures plus denses, on peut générer des sites lacunaires en substituant des ions par d’autres ions de charge différente. Par exemple, dans la zircone ZrO2, on substitue une petite partie des ions Zr4+ par des ions Y3+ : cela crée un déficit de charges positives, qui est compensé par un déficit équivalent de charges négatives sous la forme de lacunes en oxygènes. La zircone « yttriée » est un très bon conducteur anionique à haute température, car le déplacement des oxygènes nécessite de l’activation thermique.
Les diélectriques
Dans les diélectriques, les électrons sont localisés et ne peuvent pas circuler, on parle de « charges liées ». En revanche, les nuages électroniques peuvent se déformer sous l’effet du champ électrique et engendrer une polarisation électrique (séparation des charges + et -). Cette polarisation de la matière écrante le champ électrique en son sein. Elle est mesurée par la constante diélectrique.
Avec le seul mécanisme de déformation des nuages électroniques, la constante diélectrique est généralement faible. Dans certains composés, de par leur structure, il peut exister un autre mécanisme beaucoup plus efficace de polarisation. Ces composés ont un moment dipolaire permanent au niveau de leur maille. Si les moments dipolaires de toutes les mailles s’alignent, sous l’effet du champ électrique, cela génère une forte polarisation incomparable devant celle créée par les nuages électroniques (la constante diélectrique augmente de 3 à 4 ordres de grandeur). Des interactions de couplage entre ces moments dipolaires sont responsables de la rémanence de la polarisation quand on coupe le champ électrique. C’est le phénomène de ferroélectricité. Un ferroélectrique très courant est BaTiO3 : dans la structure de ce composé, les ions Ti4+ sont dans un octaèdre de 6 oxygènes, mais au lieu d’occuper le centre de l’octaèdre, l’ion Ti4+, du fait de sa petite taille, est légèrement décalé vers un des 6 oxygènes. Ce décalage entre le centre positif Ti4+ et le centre négatif, situé au centre de l’octaèdre, génère un moment dipolaire. BaTiO3 et ses composés analogues sont utilisés sous forme de couches minces céramiques, dans les condensateurs électroniques.
Un autre comportement important parmi les diélectriques est la piézoélectricité, une propriété exploitée dans les transducteurs qui convertissent signal électrique en déplacement mécanique et vice-versa : capteurs de pression, microphones, montres, générateurs d’ultra-sons, microscopie à effet de champ… Là encore l’origine de cette propriété tient dans la structure de la maille. Dans les piézoélectriques, une déformation mécanique (pression…) induit un moment dipolaire électrique en déplaçant les charges + par rapport aux charges -. Cela est possible lorsqu’aucune opération de symétrie ne vient compenser ce déplacement par un déplacement de charges opposé (on parle de structures « polaires »). Des exemples typiques de piézoélectriques sont SiO2 de structure quartz, ou ZnO de structure blende.
Les propriétés optiques
Les propriétés optiques sont étroitement liées aux propriétés électriques mais vont bien au-delà ! Tant et si bien que nous leur consacrons…qu’une petite section, car elles dépassent largement notre cadre centré sur la matière.
La lumière visible est d’abord une vibration de champ électrique, dans un petit domaine de fréquence autour de 1015 Hz (500 nm en longueur d’onde). En tant que vibration de champ E, elle déplace les charges au sein de la matière. Du fait de sa fréquence ν modérée (et donc de son énergie E = hν autour de 2 eV), elle touche les électrons les plus externes, c’est-à-dire les électrons de valence impliqués dans les liaisons chimiques (c’est bien pour cela qu’on la « voit » : elle induit des modifications électrochimiques de nos capteurs rétiniens).
L’interaction de la lumière avec la matière donne lieu à essentiellement trois phénomènes : la réflexion, la transmission et l’absorption. Ces phénomènes sont liés à la nature des électrons dans la matière. Vient s’ajouter un quatrième phénomène important qui relève de la microstructure, la diffusion.
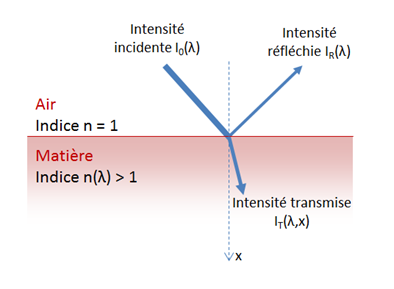 Interactions lorsque la lumière entre dans la matière. Une partie de l’intensité lumineuse incidente I0 est réfléchie, une partie est transmise et une partie est absorbée, de sorte que : I0 = IR + IT + IA. Ces trois phénomènes dépendent de l’énergie (longueur d’onde) de la lumière.
Interactions lorsque la lumière entre dans la matière. Une partie de l’intensité lumineuse incidente I0 est réfléchie, une partie est transmise et une partie est absorbée, de sorte que : I0 = IR + IT + IA. Ces trois phénomènes dépendent de l’énergie (longueur d’onde) de la lumière.
Pour bien comprendre ces phénomènes, il faut garder à l’esprit que le champ électrique déplace les électrons par rapport aux noyaux : il exerce sur eux une force et leur apporte une énergie potentielle associée, c’est l’interaction dipolaire électrique. Inversement, les mouvements des électrons par rapport aux noyaux émettent de la lumière. Mais nous sommes dans le monde infiniment petit des particules de matière, et ces échanges d’énergie lumière-matière sont quantifiés. Les particules d’énergie lumineuse échangées sont les photons, d’énergie E = hν avec ν la fréquence de la lumière (λ = c/ν la longueur d’onde, c la vitesse de la lumière). Une lumière de longueur d’onde λ va donc chercher à transférer aux électrons une énergie hν = hc/λ. Cela est possible…si les électrons sont eux-mêmes capables d’accepter cette énergie ! C’est-à-dire : s’il existe pour eux des niveaux d’énergie supérieure de hc/λ par rapport à leur niveau d’origine. Et s’ils peuvent « techniquement », au moyen du champ électrique de la lumière « grimper » dans ces niveaux d’énergie.
On voit qu’il y a donc deux conditions pour que la lumière puisse transférer son énergie aux électrons et donc être absorbée :
- Il doit exister un niveau d’énergie électronique final Ef, distant de l’énergie du niveau initial Ei par l’incrément hν : ΔE = Ef – Ei = hν.
- La transition de l’électron du niveau initial vers le niveau final par l’intermédiaire du champ électrique doit être possible : cette condition relève de la symétrie du système champ E-orbitale électronique initiale-orbitale électronique finale.
Si ces conditions ne sont pas remplies, la lumière n’est pas absorbée et est donc transmise. Mais la lumière transmise déforme légèrement et transitoirement les nuages électroniques, ce qui diminue sa vitesse et son intensité. Ce phénomène d’interaction avec le milieu diélectrique est mesuré par la fonction diélectrique complexe, dont on extraie l’indice de réfraction n(λ). Par exemple, la vitesse de la lumière dans le milieu est c/n(λ).
Deux situations extrêmement différentes surgissent selon que les électrons de valence sont en partie libres comme dans les métaux, ou liés comme dans les isolants, d’où l’association aux propriétés électriques.
Propriétés optiques des métaux
Dans les métaux comme on a vu, les électrons de valence sont distribués dans de grandes bandes d’énergie partiellement pleines. Les électrons peuvent donc absorber provisoirement la lumière en grimpant dans des niveaux supérieurs vides, puis immédiatement restituer la lumière en redescendant dans des niveaux inférieurs. En termes physiques, les électrons de conduction sont libres de se déplacer et de ce fait ils annulent le champ électrique à l’intérieur du métal : la lumière ne peut pas pénétrer un métal (sauf sur une épaisseur très petite appelée « peau » du métal, liée au fait que les électrons ne sont pas parfaitement libres).
La lumière est donc intégralement ou presque réfléchie par les métaux. Certains métaux, comme l’argent ou l’aluminium, modifient très peu le spectre de la lumière dans leur réflexion : ils sont « blancs ». Les métaux « rouges » comme l’or ou le cuivre ne restituent pas la partie violette de la lumière visible car ces transitions se font entre orbitales 3d ou 4d très couplées avec les vibrations du réseau cristallin (il y a donc restitution partielle de l’énergie sous forme de vibrations du réseau).
Le reflet métallique est très spécifique et immédiatement reconnaissable à l’œil, ce qui fait que les métaux natifs ont immédiatement été valorisés. Ces métaux pouvaient être considérés comme des morceaux de soleil, des pierres divines (chez les Incas par exemple).

Or natif dans une veine de quartz gris (Source Wikipédia)
Propriétés optiques des non-métaux
Dans les non-métaux, une petite partie seulement de la lumière est réfléchie par la déformation des nuages électroniques, l’autre partie est transmise, ou absorbée et réémise plus tard principalement sous forme de chaleur (rayonnement infrarouge produit par les vibrations des atomes). La combinaison de ces phénomènes et de celui de diffusion conduit à une diversité infinie de propriétés visuelles. Les extrêmes sont la transparence, l’opacité, la brillance, la matité… et bien-sûr les couleurs.
Transparence/opacité
A travers une vitre en verre, d’indice autour de 1.5, 5% environ de la lumière visible est réfléchie et tout le reste est transmis. Ce verre, principalement constitué de silice SiO2, est transparent et incolore comme l’eau ou l’air. Deux raisons à cela : les électrons de valence sont fortement liés (voir la structure de bande dans la section sur les propriétés électriques), et c’est un matériau parfaitement homogène jusqu’à l’échelle moléculaire, comme l’air et l’eau !
Il y a perte de transparence lorsque le matériau n’est pas parfaitement homogène, qu’il contient des interfaces avec des variations d’indice de réfraction. A chaque interface la lumière change de direction par réflexion et réfraction : elle est diffusée. Comme elle ne peut plus traverser « tout droit » la matière, le matériau est opaque. La poudre de verre est blanche et opaque car les particules de verre diffusent la lumière dans toutes les directions. Une céramique traditionnelle est opaque car elle contient de nombreuses interfaces entre différentes phases (porosité, phase vitreuse et différents cristaux).

Brillance/matité
Brillance et matité sont reliées à la planéité de la surface du matériau. Une surface parfaitement plane jusqu’à l’échelle inférieure au micron est brillante : toute la réflexion est produite dans une et une seule direction appelée direction spéculaire.
Si la surface présente une rugosité à l’échelle du micron, les directions multiples de la réflexion produisent de la matité.
Les couleurs
Une matière qui absorbe la lumière visible sur un petit domaine de longueurs d’onde est colorée. La lumière transmise ou réfléchie ne contient plus les longueurs d’onde absorbées. Elle contient les autres longueurs d’onde du spectre visible, et donc on voit la couleur « complémentaire » à la couleur absorbée.
Les colorants et pigments sont des substances qui absorbent fortement une partie de la lumière visible.
Certains pigments sont des semi-conducteurs, comme le pigment jaune CdS : dans CdS, la différence d’énergie entre la bande électronique pleine et la bande vide, ou « gap optique », est dans le violet. Tous les photons violets et d’énergie supérieure au violet sont absorbés et produisent des électrons de conduction responsables de l’opacité et de la « luminosité » de ce pigment.

Jaune de cadmium, CdS
La plupart des pigments minéraux sont des oxydes de métaux de transition, le plus ancien d’entre eux étant sans doute l’oxyde de fer rouge Fe2O3 (hematite). Tous les électrons étant fortement liés aux oxygènes, ces pigments sont des isolants, qui seraient transparents (mais fortement colorés) s’ils se présentaient sous une forme homogène. Les métaux de transition sont les métaux dont les orbitales 3d ou 4d sont partiellement remplies. Les transitions des électrons entre ces orbitales absorbent dans le visible.
De nombreuses molécules organiques absorbent dans le visible de façon très efficace : les colorants garance, indigo, cochenille… On les appelle colorants, par distinction à pigment, car ils sont dissouts à l’état moléculaire dans la matière à colorer. Les pigments sont des grains, souvent cristallins, dispersés à l’échelle microscopique dans la matière.
La couleur évoquée ici est la couleur dite d’origine chimique. Des phénomènes interférentiels peuvent aussi produire de la couleur. Ils ont pour origine une texture périodique de la surface qui diffracte la lumière, comme sur les ailes ou carapaces de certains papillons et scarabées.

Couleurs produites par la diffraction de la lumière sur la carapace de ce scarabée.
