Pourquoi parle-t-on des éléments chimiques pour le design des objets?
Qu’appelle t’on un élément chimique?
Atomes et numéros atomiques
Tableau périodique et propriétés des éléments selon leurs positions
Pourquoi parle-t-on des éléments chimiques pour le design des objets ?
Les matériaux sont de la matière utile : le designer choisit telle ou telle matière parce qu’il pense que ses propriétés sont optimales pour la fonction qu’il recherche. Ce faisant, la matière devient matériau.
Les propriétés sont la conséquence de la composition chimique donnée par des éléments chimiques constituant la matière et de sonorganisation interne à différentes échelles : sa structure et sa microstructure. Dans cette page, on parlera tout d’abord de la composition chimique.
Comment est-elle définie ? Pour cela il faut déterminer les « éléments » (particules indivisibles) de la matière. Selon la façon de définir l’indivisible (par la transformation physique ou par la transformation chimique), ces « éléments » de la matière ne sont pas les mêmes.
Prenons l’exemple de l’eau. En disant qu’on considère comme indivisible ce qui résiste à des transformations physiques connues de la physique classique (évaporation, fusion, cristallisation, etc…) l’eau gardera comme la plus petite unité la molécule H2O (2 atomes d’hydrogène, H, liés à un atome d’oxygène, O). Ce sont donc les molécules qui déterminent les propriétés physiques (température de fusion, enthalpie de fusion, etc…) et chimiques (réactivité). Les molécules n’ont évidemment pas des propriétés physiques ou chimiques elles-mêmes, ces propriétés sont macroscopiques, mais les molécules possèdent d’autres caractéristiques telles que la masse moléculaire, l’énergie de liaison, la polarité, la taille…
Si on considère les modifications chimiques possibles et on considère comme indivisible seulement ce qui ne change pas pendant ces transformations, l’eau peut être par exemple décomposée par une décharge électrique en dioxygène et hydrogène :
2 H2O = 2 H2 + O2
Dans ce cas seulement les atomes d’hydrogène (H) et d’oxygène (O) restent indivisibles en sens chimique.
Les deux termes donc, la molécule et l’atome, peuvent être considérés comme l’élément neutre indivisible de la matière. La différence entre les deux est que la molécule peut devenir « divisible » en transformation chimique, tandis que l’atome est une particule neutre de la matière indivisible chimiquement. Dans certains cas comme pour les gaz inertes (néon, krypton, argon) la molécule est formée par un seul atome portant le même nom.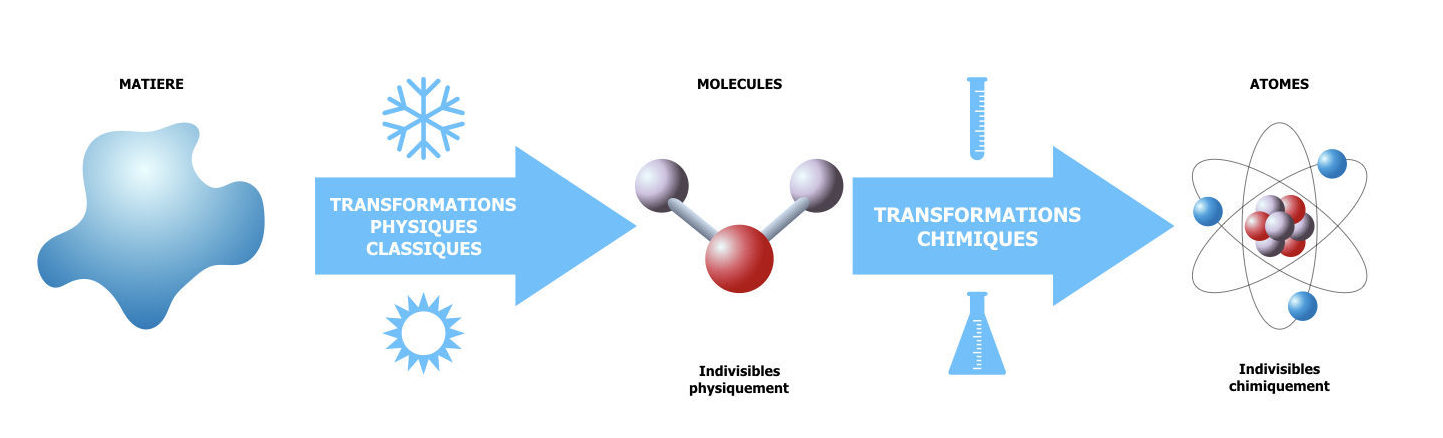
Principes d’indivisibilité
Des parties élémentaires de matière peuvent être chargées, dans ce cas on les appelle des ions. Par exemple, par la réaction de l’eau avec les métaux alcalins on forme l’hydrogène mais aussi les hydroxydes de métaux alcalins (KOH, NaOH, LiOH) :
Ex. Li + H2O = 2 LiOH + H2
Les hydroxydes formés sont composés de particules chargées « indivisibles » physiquement – les ions – Li+ et OH– (hydroxyde). Lors de la réaction ces particules sont dissociées en solution et la formation des ions hydroxyde peut être suivie avec le changement du couleur d’un indicateur coloré (phénolphtaléine), comme sur l’exemple de cette vidéo.
Si la solution est évaporée, le LiOH formera les cristaux qui seront toujours constitués de ces mêmes ions. La présence des particules chargées peut être prouvée par le fait que l’hydroxyde de Li peut conduire l’électricité, en particulier à l’état liquide (température de fusion 462°C). En même temps, le LiOH, le sel de Li (LiCl) ou le métal Li rentrant dans une flamme vont colorer la flamme en couleur rouge, montrant que malgré les différences de microstructure et de propriétés physiques il y a toujours une similarité. La couleur spécifique de la flamme obtenue en présence des certains éléments métalliques est largement utilisés pour la détection de ces éléments, et pour constituer le feu d’artifice.
Si on considère les avancées de la physique quantique, des atomes et des ions simples ne sont plus indivisibles, les atomes peuvent être transformés les uns dans les autres par des réactions nucléaires ce qui prouve que la structure d’atome est composée elle-même d’un nombre des particules qu’on appelle les particules élémentaires.
La définition de l’élément est donc plus compliquée que ce qui a été pensé par les philosophes grecs et dans la pratique chimique on définit un élément chimique.
Qu’appelle t’on un élément chimique?
Définition
Quand on définit une matière on nomme tout d’abord les éléments chimiques – les types d’atomes – qui constituent la matière. Par exemple, des éléments chimiques constitutifs des molécules de base nécessaires au développement de la vie (les éléments chimiques constitutifs de l’ADN et des acides aminés) sont le carbone (C), l’oxygène (O), l’azote (N), l’hydrogène (H), le soufre (S), le phosphore (P).
Si on regarde ces éléments, ils peuvent être présents ensemble ou séparément dans de nombreux matériaux avec des propriétés très différentes. Par exemple, l’hydrogène qui peut être présent :
– sous forme d’atomes d’hydrogène (particules non chargées consistant du seul élément chimique hydrogène) très réactives lors du soudage à l’arc de métaux légers de précision (voir cette video).
– ou sous forme d’ions (particules chargées) H+ qui s’hydratent formant les ions oxonium (H3O+ ) dans des solutions diluées d’acide chlorhydrique (HCl) ou citrique et deviennent responsables de leur acidité.
– ou sous forme de molécules H2 dans le gaz dihydrogène utilisé dans le temps pour remplir le ballon d’un montgolfière…
– ou faire partie d’une molécule H2O (molécule complexe – groupement non-chargé contenant plus d’un élément chimique) formant le réseau cristallin d’une matière solide (la glace) ou une macromolécule de polyéthylène contenant les groupement (-CH2-)X en chaînes et qui forment une structure sans périodicité – structures amorphes ou quasicristallines (avec un ordre défini mais sans périodicité)…
Dans toutes ces structures l’élément chimique présent sera l’hydrogène. Il faut donc bien faire la différence quand on prononce le mot « hydrogène » s’il s’agit de la matière (gaz dihydrogène), de l’ion (H+) ou de l’élément chimique (H).
Evidemment un élément chimique ne peut pas avoir de propriétés physiques ou chimiques connues pour la matière (ni masse volumique, ni odeur, ni couleur, ni réactivité, ni ductilité …) ! Même la masse atomique ou la charge n’est pas une caractéristique d’élément chimique – la masse d’un atome hydrogène est différente de celle d’un isotope d’hydrogène « lourd » – deutérium – formé dans certaines réactions nucléaires, la charge d’un atome hydrogène (neutre) est différent de la charge de l’ion hydrogène (« + 1» en unités de charge d’un électron).
Que-est ce qui donc permet de définir un élément chimique ?
C’est son numéro atomique Z qui reflet la charge de son noyau. Par exemple l’élément chlore (Cl) dans les molécules de Cl2, le gaz toxique qui a coûté la vie et la santé à des milliers des personnes pendant la première gère mondiale, et dans le sel NaCl, indispensable pour la vie, reste le même élément chimique caractérisé par un Z = 17.
Les propriétés des éléments chimiques
Les propriétés d’un élément chimique sont Z, la composition isotopique, l’électronégativité (la capacité de l’atome à attirer les électrons de valence des autres atomes lors de formation des liaisons chimiques), l’énergie d’ionisation (la facilité à perdre un électron de valence), le rayon atomique… Selon l’électronégativité et l’énergie d’ionisation les éléments sont classés comme métaux et non-métaux. Les propriétés des éléments chimiques sont déterminantes pour les types et les forces de liaisons chimiques qui peuvent être formées par ces éléments et par conséquence pour les propriétés physiques et chimiques des composés formés.
Les éléments chimiques peuvent donc être présents dans différentes matières et composés très variés et ce n’est pas seulement la présence d’un élément, mais le composé et son environnement qui vont déterminer les propriétés de la matière.
La multitude de propriétés de la matière est jouée avec un nombre bien limité d’éléments, seulement 118 éléments ont été observés à ce jour dont certains ne sont pas stables et ont un temps de vie de moins d’une seconde. Ces éléments sont disposés dans un tableau en ordre d’augmentation de Z qui s’appelle le Tableau Périodique. Une bonne compréhension du lien entre la structure atomique et la position de l’élément dans le tableau périodique permet de prévoir l’évolution des propriétés des éléments selon leurs positions dans le tableau périodique et par conséquent les propriétés physiques et chimiques des composés qui sont formés par ces éléments.
Atomes et numéros atomiques
Un atome contient un noyau chargé positivement situé en son centre et des électrons qui « tournent autour » du noyau. Le noyau contient des nucléons, c’est à dire des protons avec une charge positive (+1 en unité de charge de l’électron) et des neutrons avec une charge nulle, les deux ont une masse d’une unité atomique (1/12ème de la masse de l’atome C d’isotope 12C). Les électrons ont une charge électrique négative (-1 en unité de charge de l’électron). La charge du noyau est + Z : c’est donc le nombre de protons dans le noyau. Z est appelé le numéro atomique, c’est lui qui définit l’élément chimique : l’élément chlore, de Z = 17, est l’ensemble des entités (atomes, ions) dont la charge nucléaire est Z = 17.
Un atome est un élément chimique électriquement neutre. Un atome d’un élément chimique avec le numéro Z, soit Z protons dans le noyau, contient donc forcément Z électrons pour sa neutralité. Selon la façon dont les électrons bougent, la forme du nuage électronique (la zone d’espace à l’intérieur de laquelle la probabilité de trouver un électron est supérieure à 90 %) peut être différente et l’énergie des électrons du nuage sera différente. Les différentes formes de mouvement des électrons sont les orbitales atomiques. Leurs formes et niveaux d’énergie émergent de la nature quantique des électrons.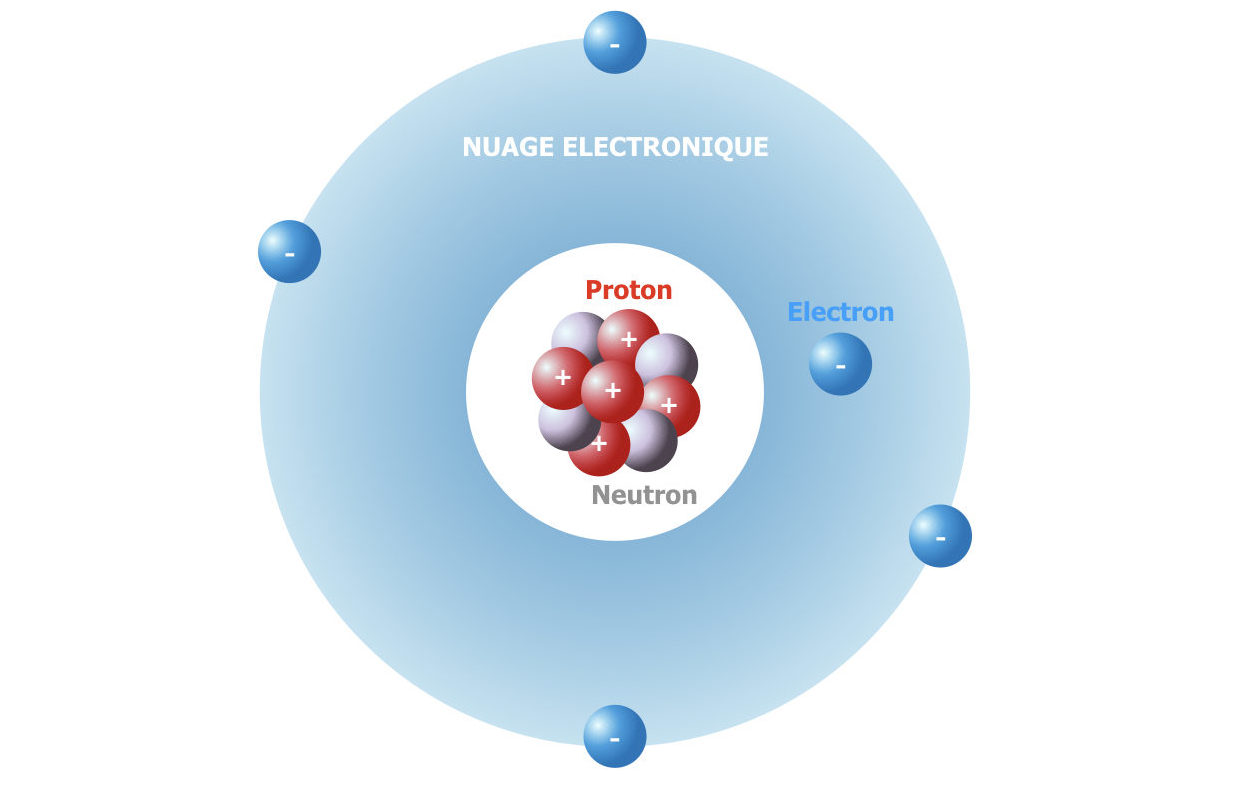 La structure d’un atome
La structure d’un atome
Voir aussi cette page sur la structure des atomes.
Isotopes
Le même élément chimique peut former plusieurs atomes dont les noyaux contiennent le même nombre de protons (donc le même Z) mais différents nombres de neutrons (donc posséder une masse atomique différente). Ces différents atomes d’un même élément chimique s’appellent les « isotopes ». Les réactions nucléaires contribuent à la formation des différents isotopes d’un même élément et les isotopes plus lourds perdent des neutrons avec le temps et deviennent donc plus légers. La composition isotopique d’un échantillon peut donc dire beaucoup sur son histoire. L’analyse isotopique est largement utilisée pour l’identification des nombreux phénomènes et la datation des objets, voir les exemples en climatologie et en datation.
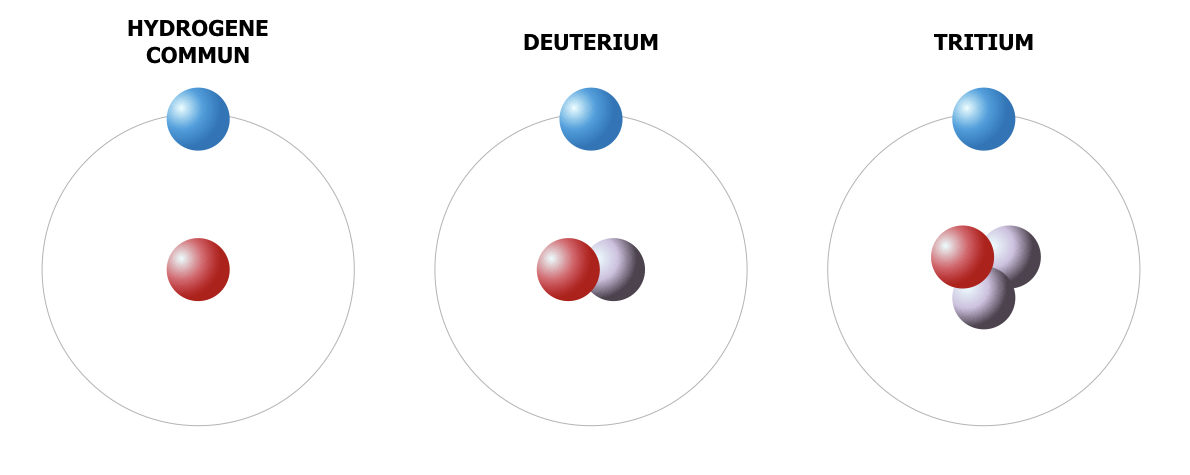 Les trois isotopes de l’hydrogène
Les trois isotopes de l’hydrogène
Molécules
Une molécule est la plus petite partie d’un corps susceptible d’exister à l’état isolé en gardant les caractères de ce corps lors des transformations physiques. Une molécule est formée d’atomes qui sont liés par des liaisons chimiques essentiellement covalentes qui maintiennent les noyaux dans une certaine géométrie. Ces liaisons se forment à travers le partage des électrons de valence des différents atomes, dont les orbitales se déforment à cause du recouvrement et finissent par former les orbitales moléculaires. Selon le nombre et la nature des éléments formant la molécule et la symétrie et l’énergie de ses orbitales moléculaires, les molécules possèdent des caractéristiques telles que la masse moléculaire, l’énergie de liaison, la polarité, la polarisabilité, la taille, …
Ions et énergie d’ionisation
Un ion est un atome ou une molécule dont on a enlevé ou ajouté un ou plusieurs électrons. Ainsi, un atome ou une molécule étant toujours électriquement neutre, un ion est soit positif soit négatif. Un ion a donc des propriétés physico-chimiques différentes de la molécule dont il provient. Un ion positif est appelé un cation et un ion négatif est appelé un anion. L’énergie nécessaire pour obtenir un ion à partir d’un atome en ramenant l’électron de valence (l’électron le moins fortement lié avec le noyau) d’un atome ou d’une molécule à une distance infinie des noyaux s’appelle l’énergie d’ionisation.
Tableau périodique et propriétés des éléments selon leurs positions
La genèse du tableau périodique
Les éléments chimiques sont actuellement classés dans un tableau périodique par ordre de numéro Z croissant. Le tableau comporte 18 colonnes (groupes) et 8 rangées (périodes) qui permettent de révéler la périodicité de certaines propriétés des éléments. Ce tableau a été le fruit d’une longue recherche de classification par plusieurs chimistes du XIXème siècle, suite à l’accumulation significative des connaissances phénoménologiques grâce aux progrès de la chimie expérimentale. L’objectif de l’époque a été d’organiser les séries chimiques connues dans un schéma cohérent. La structure de tableau publiée par Dmitrii Mendeleev a réussi non seulement à mettre en cohérence tous les groupes connus à l’époque mais aussi à prévoir les propriétés d’éléments qui n’avaient pas encore été découverts. Selon la légende, la forme du tableau est apparue à Mendeleev dans son sommeil. Une fois le tableau vu, Mendeleev a eu le courage de déplacer certains éléments en rompant l’ordre des masses atomiques en faveur d’autres propriétés et l’histoire lui a donné raison. L’histoire de la recherche sur la classification périodique peut être consultée dans ce lien et cet autre lien.
L’explication actuelle des motifs dans le tableau périodique provient du fait que les éléments d’une même colonne (même groupe) possèdent la même configuration de leurs électrons externes. Comme le comportement chimique est principalement dicté par les interactions de ces électrons, appelés électrons de valence, cela tend à donner aux éléments d’un même groupe les mêmes propriétés chimiques et physiques.
Pour comprendre le lien entre le numéro atomique et les propriétés des éléments chimiques il faut comprendre la structure électronique de l’atome (c’est-à-dire : comment les électrons s’organisent dans l’atome) et comment cette structure est révélée par la forme du tableau périodique.
Energie potentielle des électrons de valence et propriétés des éléments chimiques
La facilité à former des liaisons chimiques (et donc la réactivité et autres propriétés chimiques) est déterminée par la facilité à accepter les électrons de valence d’un autre atome dans ses orbitales ou à « perdre » ses propres électrons de valence pour les donner ou les partager avec un autre atome. Cet échange va être fonction de l’énergie des électrons de valence dans leur atome.
Il est très compliqué, voire impossible, de connaître la valeur exacte de l’énergie d’un électron dans un atome car pour cela il faut connaître toutes les interactions avec toutes les autres particules et tous les mouvements dans lesquels il participe, ce qui est impossible. Pour le niveau zéro d’énergie, on prend l’énergie d’un électron dans le vide à une distance infinie de noyau. Lorsqu’il est près du noyau, l’électron ne peut pas avoir toutes les énergies et positions possibles mais il peut prendre les positions et les énergies qui correspondent à des orbitales atomiques. Chaque électron à l’intérieur d’une orbitale atomique est décrit à l’aide de 4 nombres quantiques liés :
- au niveau d’énergie : nombre n = 1, 2, 3…
- au moment cinétique, donnant la vitesse et la direction du mouvement et donc la forme de l’orbitale et son orientation par rapport à un axe comme, par exemple, l’axe d’un champ magnétique : nombres l et m, avec l=0 …n-1 et m=0…+/-l
- au spin, donnant les vitesse et direction de rotation de l’électron sur lui-même : s = 1/2 et ms = +1/2 ou ms = -1/2.
Si on veut illustrer les conséquences de ces nombres sur les propriétés de l’atome, il est clair que l’électron qui se trouve sur un niveau avec un n plus bas va être plus fortement lié avec le noyau et aura donc une plus grande énergie d’ionisation. Par conséquent, pour le même atome les électrons des niveaux extérieurs avec le n le plus élevé sont le moins liés avec le noyau. Ces électrons participent donc plus facilement aux liaisons chimiques avec les autres atomes et s’appellent les électrons de valence. En comparant deux atomes avec le dernier niveau énergétique occupé n différent, il est clair que celui qui a le n le plus élevé aura l’énergie d’ionisation la plus faible et le rayon atomique le plus élevé.
Structure électronique et position dans le tableau périodique
En comparant les formes des orbitales s (l=0, m=0, une orbitale), p (l=1, m=0, +/-1, 3 orbitales), d (l=2, m=0, +/-1, +/-2, 5 orbitales) et f (l=3, m=0, +/-1, +/-2, +/-3, 7 orbitales) on peut constater que, à cause des nombres m multiples, leur forme devient de plus en plus « diffuse ». Ce qui augmente un peu le rayon et diminue la probabilité de trouver l’électron près du noyau. Les énergies de ces sous-niveaux électroniques augmentent donc dans le même ordre : pour un même niveau n, l’énergie de l’orbitale s est plus basse que celle des orbitales p, puis d, puis f.
En sachant que les nombres quantiques n et l définissent les niveaux d’énergie et le nombre d’orbitales de chaque niveau, une première classification peut se présenter comme suit :
[Figure page 33]
Une fois que l’ordre des énergies des orbitales est respecté on peut prévoir leur remplissage par les Z électrons de l’élément de numéro Z. Pour cela il suffit de respecter un certain nombre de règles dont on donne les plus simples applicables à des éléments s, p et d :
- Tout d’abord, les niveaux se remplissent en commençant par ceux dont les interactions entre l’électron et le noyau sont les plus fortes, c’est-à-dire par ceux donc l’énergie est la plus basse.
- Ensuite, on remplit en plaçant 2 électrons par orbitale, selon le principe d’exclusion de Pauli : 2 électrons ne peuvent pas avoir leurs 4 nombres quantiques identiques.
Pour les éléments de numéro atomique Z de 1 à 18 on a donc la structure suivante :
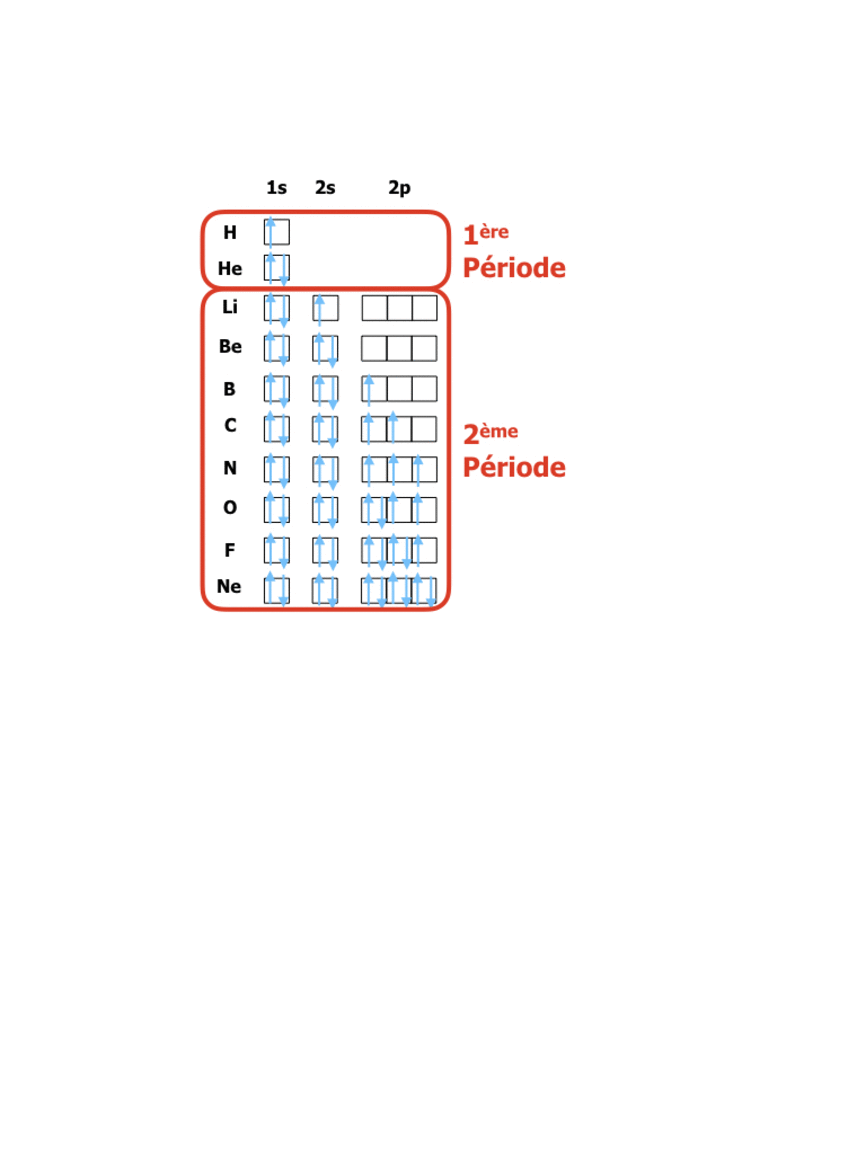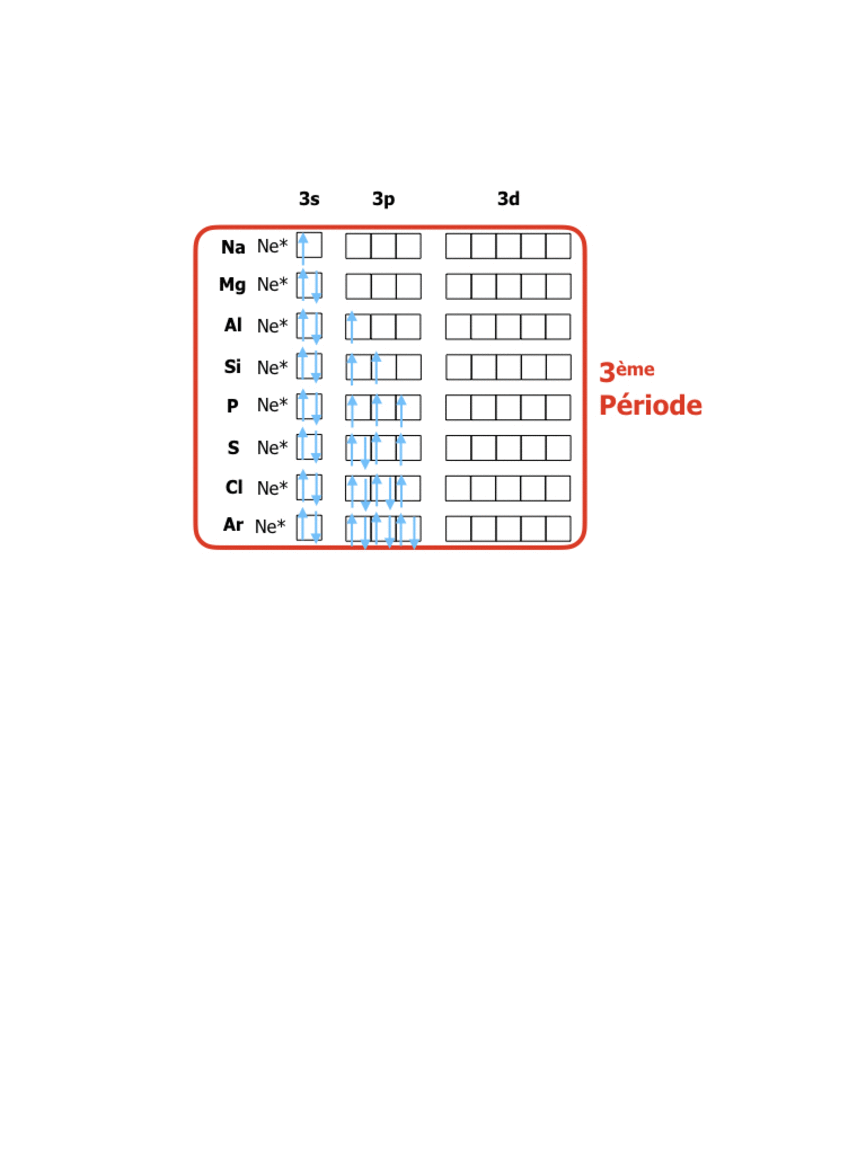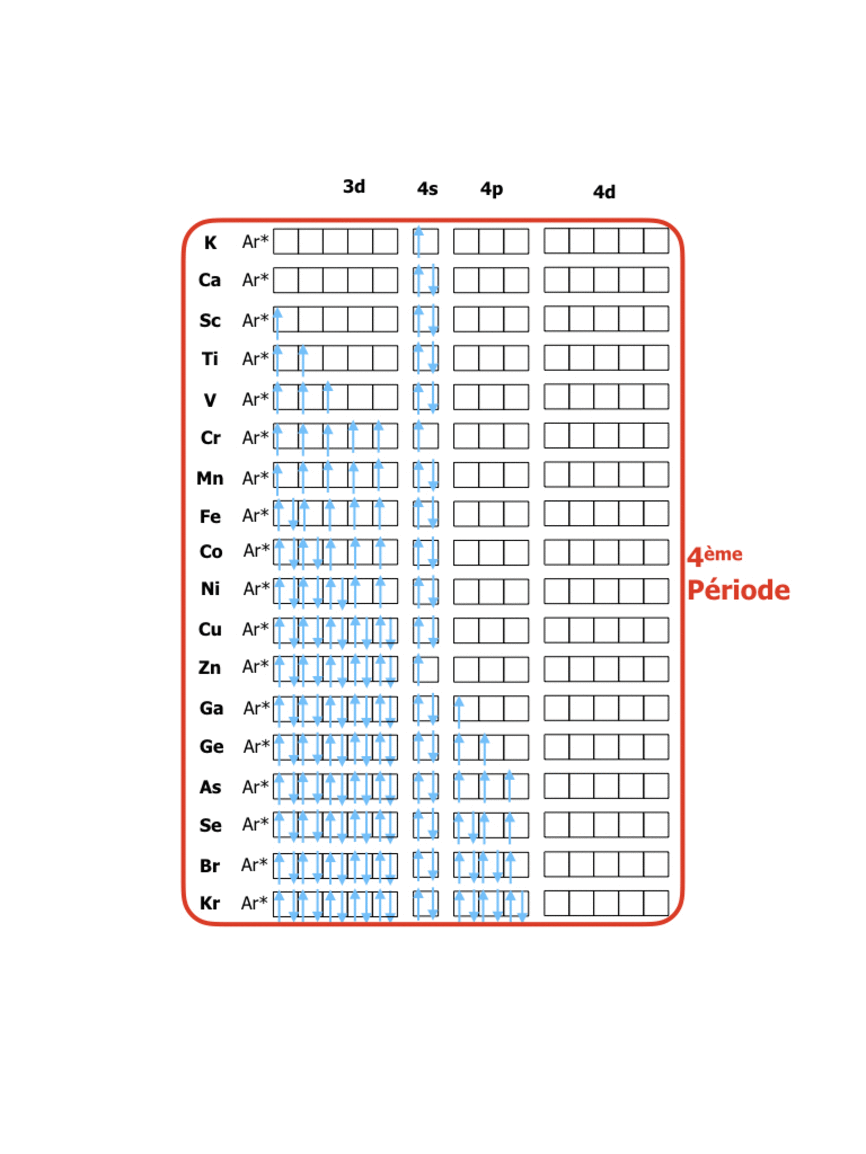
En comparant ces configurations avec la position dans le tableau périodique (lien vers tableau) on peut constater que : le tableau périodique organise les éléments de façon à ce que les numéros des rangées (périodes) correspondent à la valeur du niveau énergétique n des électrons de valence, tandis que les numéros de colonnes (groupes) indiquent le nombre d’électrons sur le dernier niveau de valence. La formation de 8 groupes principaux correspond donc à des éléments avec les niveaux de valence s et p (soit 8 électrons dans 4 orbitales), tandis que les 18 groupes au total sont dus à l’apparition des électrons d (10 électrons dans les 5 orbitales d)…
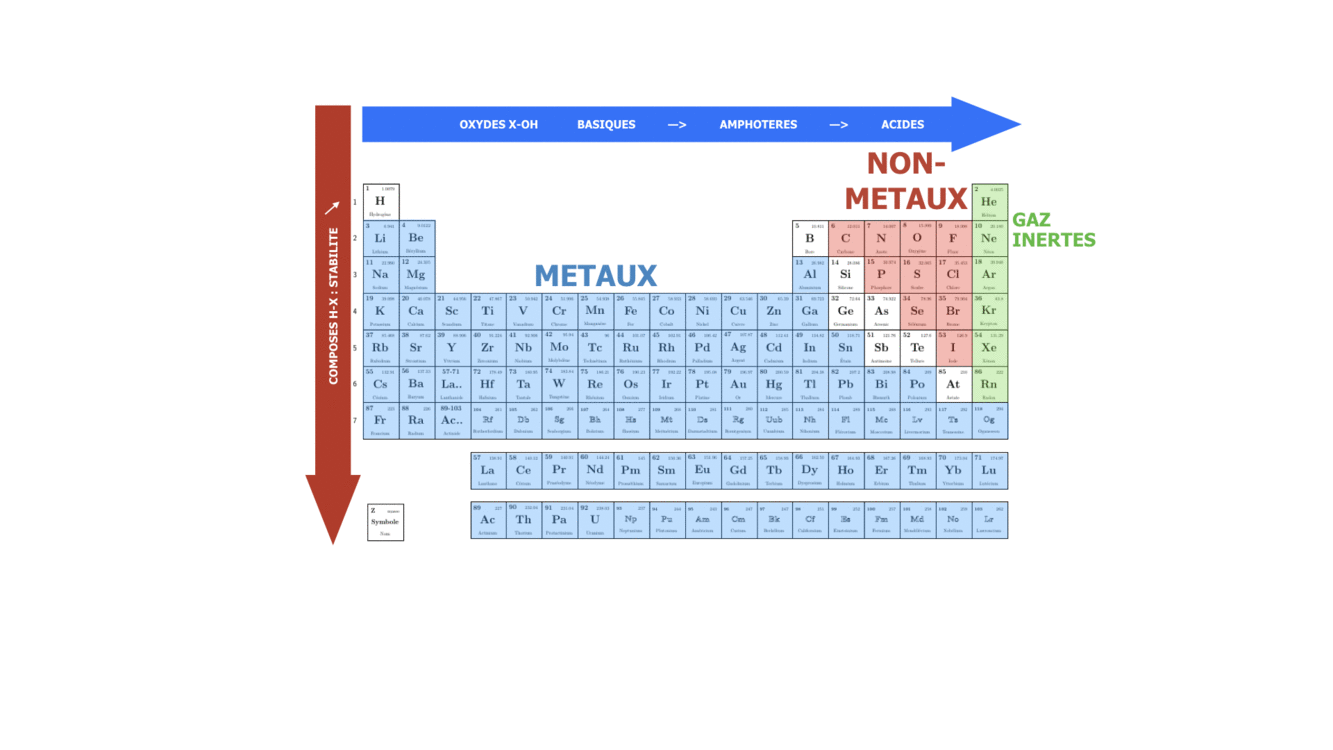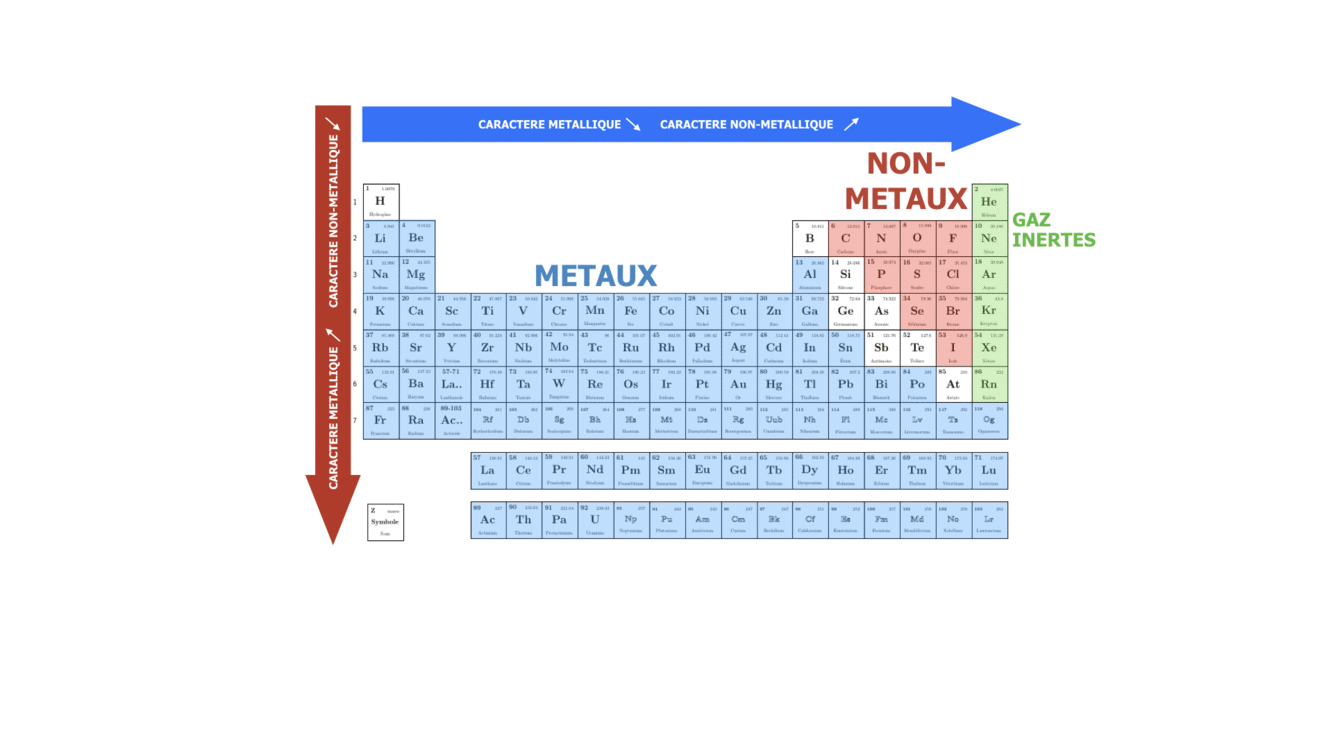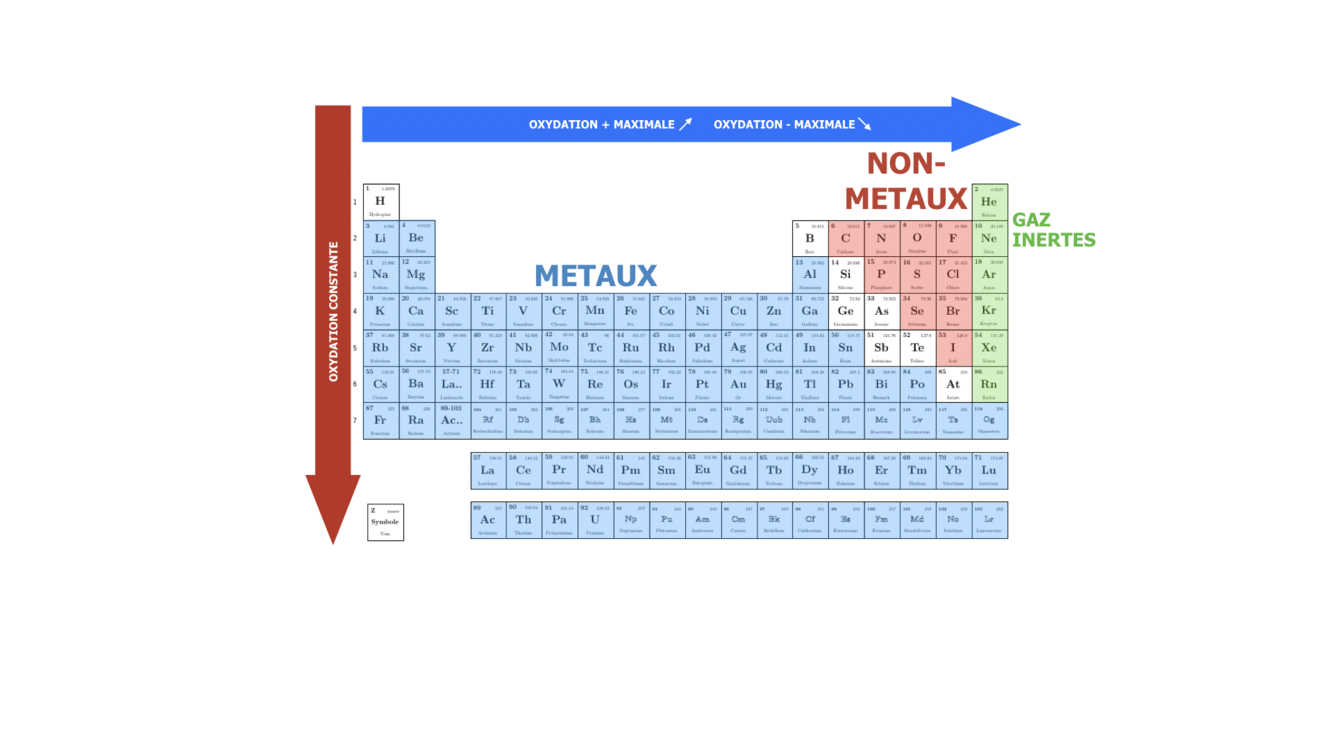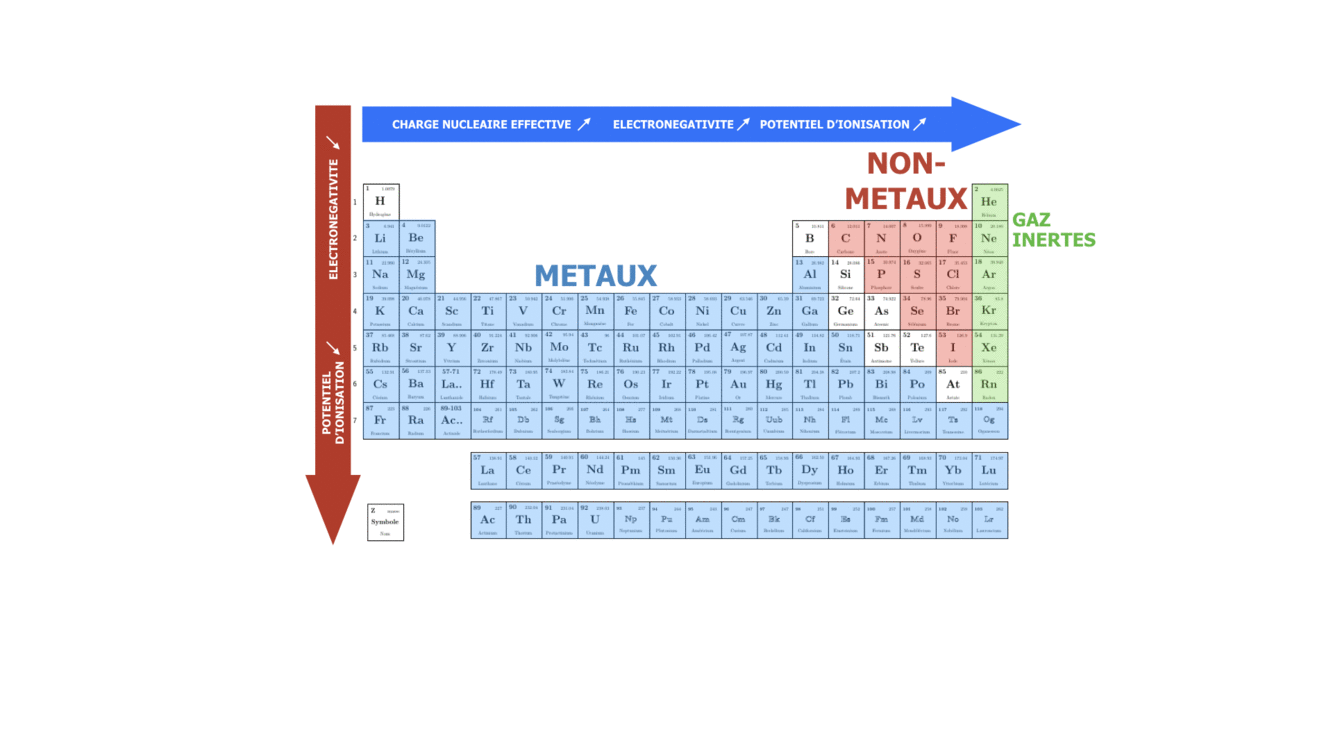
SI on se déplace dans une période ou qu’on descend dans un groupe, on fait varier le caractère plutôt métallique, non-métallique ou inerte de l’élément chimique. Sachant que n augmente de haut en bas, on peut dire que dans le groupe le caractère métallique augmente avec le numéro de la période, tandis que le caractère non-métallique augmente avec le numéro du groupe, surtout pour des éléments s et p.
article écrit par Polina Volovitch


