Les éléments chimiques sont les plus petits grains de la matière: il y en a une centaine dans la nature, qui diffèrent par le nombre de protons dans leur noyau (noté Z) et d’électrons dans leur nuage électronique. Les éléments sont classés par Z croissant dans le tableau périodique. Les électrons les plus externes participent à la liaison chimique, on les appelle électrons de valence. Deux types d’éléments sont distingués selon le remplissage du niveau de valence, les métaux (à gauche dans le tableau) et les non métaux (à droite dans le tableau)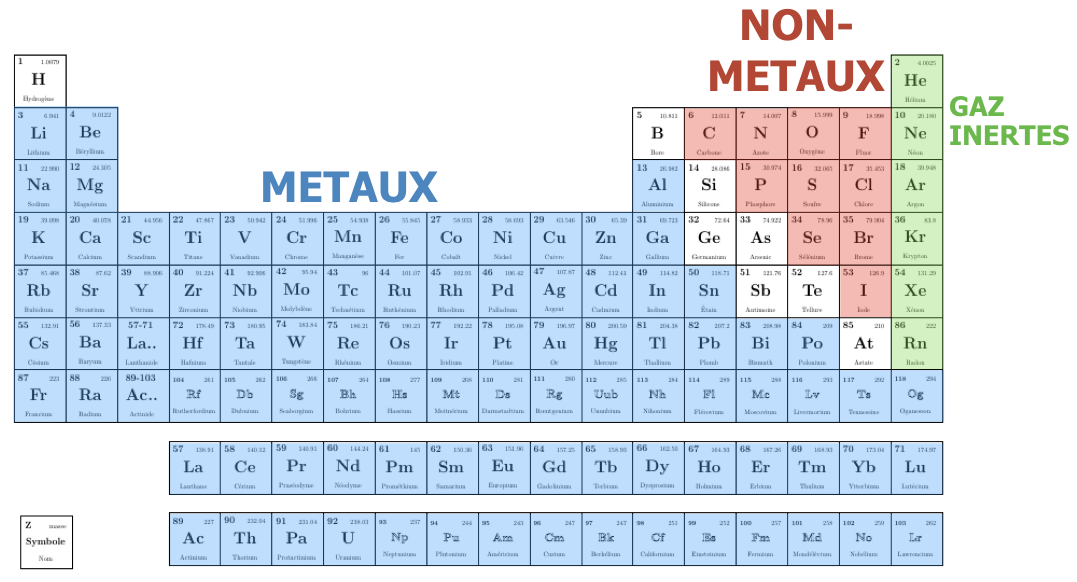
Les interactions entre électrons et noyaux sont à l’origine des liaisons chimiques et de la cohésion de la matière. Les électrons et noyaux n’ont pas d’équivalent classique, ce sont des objets quantiques qui ont un caractère de particules et un caractère ondulatoire. On les décrit par des états, qui se combinent entre eux (interagissent, interfèrent) pour former d’autres états. Les états des électrons de valence dans la liaison chimique sont plus bas en énergie, donc plus stables, que les états de ces électrons dans les atomes séparés.
Selon le niveau de délocalisation ou de localisation des électrons de valence, on distingue plusieurs types de liaison chimique : la liaison métallique, la liaison ionique et la liaison covalente. Les molécules organiques sont essentiellement construites avec des liaisons covalentes. Les sels sont des composés ioniques. Les métaux se fondent sur la liaison métallique. Mais la plupart des composés combinent plusieurs caractères : par exemple les oxydes sont iono-covalents mais peuvent aussi avoir un caractère métallique. Certains métaux sont très covalents.
Les propriétés électriques, optiques, thermiques découlent directement de la distribution des états électroniques dans la matière. Un exemple célèbre est celui du carbone : le diamant et le graphite. La différence de leurs propriétés vient de deux états différents des quatre électrons de valence du carbone (états notés sp4 et sp3) proches en énergie. Dans l’état sp3, un électron sur quatre est délocalisé et donne un caractère métallique au graphite. En conséquence le graphite est conducteur, absorbant (noir), et possède un reflet métallique. Dans l’état sp4, les quatre électrons sont localisés dans les quatre liaisons C-C. Le diamant est isolant, transparent, avec un éclat non métallique.


Les interactions entre électrons et noyaux dans la matière dépendent de l’arrangement spatial relatif des atomes, c’est-à-dire de la structure à l’échelle atomique. Inversement, la structure est déterminée par ces interactions. La structure adoptée est celle qui minimise l’énergie totale du système des électrons et noyaux. Il s’agit d’un principe d’ordre : un certain ordre local s’établit, qui se répète à l’infini dans les trois directions de l’espace, engendrant la périodicité. On parle d’ordre cristallin.
Il n’existe pas que ce principe d’ordre (énergie potentielle ou enthalpie). Il existe aussi un principe de désordre (entropie), dans l’énergie libre totale du système d’atomes à toute température. Ce principe de désordre vient du caractère aléatoire, ou chaotique, du mouvement thermique des atomes. Le mélange est un bon exemple pour comprendre l’entropie: du fait du mouvement thermique aléatoire, un système fait de deux sortes d’atomes A et B va forcément évoluer vers l’état « totalement mélangé » qui correspond au plus grand nombre de configurations, ou microétats, possibles : par définition de l’entropie, cet état est celui d’entropie maximale.
La matière à l’échelle microscopique est donc un compromis entre un principe d’ordre et un principe de désordre à la température considérée. On va trouver des structures cristallines, mais aussi des « défauts » de cristallinité à plus ou moins grande distance, du mélange chimique, etc. La science qui décrit cet équilibre entre ordre et désordre, entre enthalpie et entropie, est la thermodynamique. Elle permet de prévoir les changements de structure, la proportion de défauts intrinsèques comme les lacunes, ainsi que la possibilité et l’étendue des mélanges. Autrement dit, elle prévoit les domaines d’existence des phases. La matière est généralement constituée d’une ou plusieurs phases en équilibre interne et en équilibre entre elles. Certaines matières sont par nature hors d’équilibre, comme les verres.
Mais les propriétés de la matière ne dépendent pas que de l’échelle locale (l’échelle de la phase). Généralement, un même ordre cristallin continu n’existe que sur une petite distance (de l’ordre du µm). On parle de grain cristallin. A l’échelle du micron, la matière est structurée par l’arrangement relatif des grains cristallins. Lorsque plusieurs phases sont en présence, l’arrangement relatif des phases ajoute un niveau de complexité. On parle de microstructure. Les propriétés mécaniques sont très dépendantes de la microstructure. Mais la microstructure joue aussi sur les propriétés optiques (diffusion…), électriques, etc.
La microstructure peut être contrôlée par le procédé d’élaboration. C’est tout l’art des forgerons, par exemple.

Quand on s’intéresse à une propriété, il est important de bien voir de quels phénomènes elle dépend aux différentes échelles. Dans les liens suivants, nous nous intéressons aux propriétés optiques et électriques, thermiques, mécaniques, chimiques.
Dans la semaine PSL MIAO, nous cherchons à mettre en valeur les propriétés chimiques des matériaux, car elles sont relativement méconnues en dehors de la communauté chimiste. Il est utile, au préalable, de préciser comment on sélectionne une matière pour en faire un matériau utile, c’est-à-dire performant dans l’accomplissement de sa (ses) fonction(s). Ces méthodes de choix des matériaux nécessitent de classer les matériaux pour comparer leurs propriétés. Nous rappelons donc l’ensemble des caractéristiques chimiques et propriétés communes qui permettent de distinguer les matériaux polymères, les métaux et alliages, et les céramiques et verres. Pour obtenir certaines fonctions, il est possible de modifier les matériaux soit en volume (les composites et les matériaux hybrides) soit seulement à leur surface (couches minces, revêtements).
